Ржавчина... враг номер один почти любого металла. «Рыжая чума», с завидным упорством и постоянством превращающая сотни тысяч тонн сверкающей высокосортной, высокопрочной, легированной стали в груды коричневого порошка. Но существуют лекарства и от нее: лаки и краски, битумы и мастики, гальванические покрытия — все они в принципе должны защитить металл. Но на деле все не так просто.
Очень остро проблема защиты от коррозии стоит, к примеру, перед автомобилистами. Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
Электродный потенциал? А какое он, собственно, имеет отношение к коррозии металлов? Оказывается, самое непосредственное.
Если опустить в сосуд с электролитом два электрически связанных между собой металлических электрода, то один из них начнет растворяться, другой же останется в неприкосновенности. Так вот, оказывается, растворяется металл, электродный потенциал которого выше. Это свойство гальванической пары и дало возможность использовать эффект сохранения катода для предохранения от злектрохииической коррозии кузова автомобиля. Судостроители давно уже используют этот принцип предохранения внутренней части трюма от коррозии — они размещают внутри корпуса специальные металлические аноды (из
металла с более высоким электродным потенциалом, чем у металла корпуса).
По отношению к железу более активными металлами являются кадмий, хром, цинк, магний и другие металлы. Относительно алюминия необходимо отметить, что приведенный потенциал соответствует чистому алюминию без оксидной пленки, которой он покрывается в обычных условиях достаточно быстро. Вместе с тем тот металл, который в обиходе называется алюминием, также пригоден для защиты железа и низколегированных сталей. На практике наибольшее применение для защиты корпуса автомобиля нашли цинк и сплавы магния. Металл, который используется в качестве анода для защиты, называется протектором, отсюда и название данного метода- протекторный.
Этот способ недавно взяли на вооружение и автомобилисты.
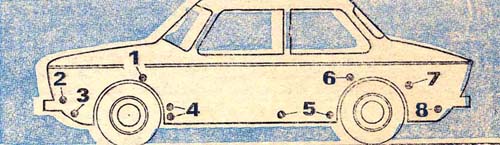
Р и с. 2. Установка электродов в этих точках наиболее эффективна:1 — коробчатые усилители брызговиков, 2 — места крепления фар и подфарников, 3 — нижняя часть передней панели, 4 — полости за щитками-усилителями передних крыльев, 5 — внутренние поверхности дверей и порогов, 6, 7 — передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 — фартук задней панели.
Для реализации протекторной защиты необходимо протектор плотно закрепить на чистой поверхности защищаемого металла. Если на эту конструкцию будет воздействовать влага, то в соответствии с приведенной выше химической реакцией электроны протектора будут переходить в защищаемый металл и на катоде (корпусе автомобиля) начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами ОН), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор Таким образом обеспечивается катодная защита корпуса автомобиля до тех пор, пока протектор полностью не разрушится вследствие коррозии. После этого, как и положено, начнет корродировать корпус автомобиля.
Необходимо отметить, что данный метод защиты корпуса автомобиля уже используется как в отечественной, так и в зарубежной практике. В частности те части кузова, которые подвергаются наибольшему воздействию влаги изготавливаются из стали с одно или двусторонним цинковым покрытием толщиной около 0,08 мм. При скорости коррозии цинка порядка 0,02 мм/год этого покрытия в нормальных условиях (без его повреждения) хватает на несколько первых лет эксплуатации автомобиля.
Для анодной защиты применяют оребренные (для увеличения поверхности) куски цинка. С помощью вделанных в них постоянных магнитов они прикрепляются в наиболее труднодоступных и загрязняемых местах кузова. Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоедикяется к кузову.
На его ребрах собирается дорожная грязь, влага, поваренная соль, и комплект «цинк — сталь» начинает работать так, как работает всем известный гальванический элемент. При работе такой «батареи» происходит растворение цинкового анода, катод в данном случае не расходуется.
Процесс коррозии напоминает работу гальванического элемента, поскольку сталь представляет собой в основном сплав железа и углерода, то есть веществ с различныик электродными потенциалами. При попадании на поверхность такого сплава электролита между зернами железа и углерода начинает идти электрохимическая реакция, сопровождающаяся растворением анода (железа) и переходом его в гидраты,а затем и в окислы.
Присутствие же электрически связанного с основным металлом цинкового электрода в корне меняет картину. По отношению как и железу, так и к углероду цинк представляет совой металл с более высоким злектродным потенциалом, то есть выступает в роли анода. Поэтому при наличии электропроводкой среды, которая практически всегда присутствует на поверхностях автомобильного кузова, электрохимическая реакция идет с растворением анода (цинка), при сохранении катода, то есть металла кузова.
Как показали эксперименты, цинкового электрода величиной со спичечную коробку хватает на 3 — 5 лет.
Обманите «рыжую чуму». Подсуньте ей приманку — кусочек металла с электродным потенциалом выше, чем у стали. Коррозия охотно вцепится о него, забыв про кузов вашего автомобиля как минимум на три года.
(По материалам журнала «Тeknik for alla», Швеция)
P.S.Несколько лет тому назад в автомагазинах продавались комплекты
цинковых электродов
для защиты кузовов, но особым успехом у покупателей они не пользовались и потому исчезли с прилавков магазинов. А зря, по-моему. КАТОДНАЯ ЗАЩИТА ОТ КОРРОЗИИ
Метод катодной защиты от коррозии уже существует давно . Подземные газопроводы перед укладкой обрабатывают антикоррозийными составами и обматывают специальной лентой. На определенном расстоянии от трубопровода закапывают анод (электрод) - металлическую болванку или рельс, к которой подключают "плюс" источника постоянного тока, а к самой трубе - "минус". Благодаря разности потенциалов между электродом и защищаемым металлом в цепи образующегося электролита (влага, соль и т.п.) проходит ток. На аноде происходит освобождение электронов - реакция окисления, и саморастворение катода прекращается. Срок службы газопровода значительно увеличивается.Так применения СКЗ позволило эксплуатировать газопровод более 30 лет без аварий, результат- поверх трубы нарост около 3-5 мм осевшего металла. А почему бы не применить этот метод для сохранения кузова автомобиля?
При катодной поляризации металлу нужно сообщить такой отрицательный потенциал, при котором его окисление становится минимальным. Для железа и его сплавов полная защита от коррозии достигается при потенциале 0,1...0,2 В. Дальнейший сдвиг потенциала мало влияет на степень защиты. Плотность защитного тока должна быть в пределах 10...30 мА/м2. Кроме того, со временем на металле за счет концентрационной поляризации по кислороду наблюдается дополнительное смещение потенциала в отрицательную сторону, что позволяет периодически выключать устройство (при ремонте автомобиля, зарядке аккумулятора и т.п.) Устройство защиты от коррозии состоит из электронного блока и защитных электродов. На корпусе электронного блока размещают световую индикацию работы устройства.
Устройство позволяет поддерживать значение потенциала влажных участков поверхности кузова на уровне, необходимом для полной остановки и прекращения коррозийных процессов за счет разрушения защитных электродов.
В качестве защитных электродов (анодов) могут использоваться как разрушающиеся материалы (нержавеющая сталь, алюминий), требующие замены через 4...5 лет, так и неразрушающиеся. В качестве неразрушающихся электродов можно применять карбоксил, магнетит, графит или платину.
Для защиты кузовов используются аноды в виде небольших металлических пластин, припаянных к концам длинных проводов, вторые концы которых закреплены в точке Вых (см. рис.) устройства. Каждую пластину, в свою очередь, необходимо с помощью клея (эпоксидная смола) приклеить к заранее выбранным и очищенным от грязи местам кузова автомобиля, наиболее подверженным коррозии (рис.выше).
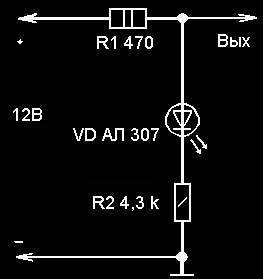
На рисунке приведена схема простого антикоррозийного устройства, которое может успешно справляться с явлениями коррозии. Конечно, в простейшем виде устройство катодной защиты может состоять из защитных электродов и проводов, подключаемых непосредственно на "плюсовую" клемму аккумулятора. Однако здесь трудно контролировать возможное короткое замыкание электродов с кузовом автомобиля и его работу в целом. Для этого в устройстве в цепь делителя напряжения R1, R2 включен светодиод VD1, который в рабочем режиме светится ровным светом, потребляя незначительный ток от аккумулятора (около 2 мА). Если вдруг один из защитных электродов замыкается на кузов автомобиля, светодиод VD1 прекращает светиться. В этом случае необходимо найти и устранить замыкание. При повышенной влажности кузова светодиод VD1 может в небольших пределах изменять свое свечение, что указывает на работу катодной защиты. Кроме того, данное устройство имеет высокую надежность, поскольку дает при коротком замыкании выхода с кузовом ток замыкания не более 25...30мА.
При установке и монтаже устройства следует помнить, что:
- один защитный электрод защищает площадь с радиусом около 0,25...0,35 м;
- защитные электроды устанавливаются только на места, защищенные лакокрасочным покрытием;
- использовать можно только эпоксидный клей или шпатлевку на его основе;
- наружную сторону защитных электродов (где нет пайки) нельзя покрывать мастикой, краской, клеем или другим электроизоляционным покрытием.
Электронный блок устанавливается в любом месте автомобиля и присоединяется к общей схеме электрооборудования автомобиля. При этом необходимо, чтобы электронный блок оставался включенным даже при отключенном общем электрооборудовании автомобиля. В целом устройство потребляет не больше чем часы автомобиля и гарантирует длительную эффективную работу даже при сильно разряженном аккумуляторе.
Еще одна Электрическая схема простейшего устройства приведена на рис. 1. 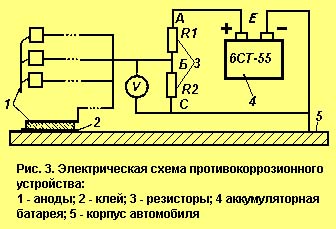
Устройство содержит делитель напряжения, выполненный на двух резисторах сопротивлением R1 и R2 соответственно. Верхний по схеме вывод резистора R1 соединен с положительным выводом аккумулятора, нижний по схеме вывод резистора R2 соединен с отрицательным выводом. При таком соединении резисторов в точке Б относительно метала кузова автомобиля будет потенциал V1, который определяется из выражения
U = Е х R2/(R1 + R2)
где Е — напряжение аккумулятора 12 В.
Потенциал U должен быть равен защитному потенциалу, при котором прекращается процесс коррозии. При последовательном соединении резисторов через них течет ток, равный I = E/(R1 + R2)
Сила тока (01-100 мА) выбирается из условия, что при обычной влажности один анод надежно защищает примерно 4-10 дм2 площади. R2 = V/I; R1 = (E/I) - R2
Если по каким-либо причинам необходимо изменить значения защитного потенциала или силу тока, соответствующие значения сопротивлений резисторов могут быть определены из приведенных соотношений. К точке 1 делителя необходимо припаять длинные провода (в изоляции), к другим концам которых припаять стальные пластины—аноды.
Каждый анод представляет собой пластину из низкоуглеродистой стали прямоугольной формы размерами примерно 2х2 см. Для защиты можно использовать и внешние аноды, о чем будет сказано далее. Предлагаемое устройство превращает корпус автомобиля в катод, который в процессе эксплуатации будет восстанавливаться за счет окисления анодов. Конструкция устройства — произвольная.
Продолжим рассуждения о катодной защите кузова.
Моя первая схемка базировалась на +1 В. Сейчас схема упрощена до примитива. С клемы +аккумулятора через предохранитель в колодке далее выключатель и резистор параллельно которому включена цепочка: резистор последовательно светодиод, напряжение подается через тросик на грунт. Относительно кузова в точке касания тросом мокрого асфальта напряжение +12 Вольт, но уже на расстоянии 0,1 м +0,7/1,0 Вольта и далее в пределах +0,7/0,4 Вольта (дождевая вода не идеальный проводник). Измерения проводились цифровым вольтметром. Ток цепи крайне мизерный (единицы микроампер). Интересно, что плюсовой потенциал сохраняется некоторое время даже после отключения устройства. На авто не оборудованных таким устройством потенциал обратный (+ 0,7/0,4 на кузове относительно земли), т.е корродирует кузов.
При катодной защите главное не напряжение (+0,7В), а некоторое значение тока, вернее даже не сам ток, а плотность тока. Эти параметры зависят от электропроводности воздушной среды, от площади незащищенной лакокрасочным покрытием поверхности, ну и конечно же от напряжения. При низкой влажности потенциал +12 Вольт через резистор, ограничивающий ток. При сильной влажности напряжение на выходе схемы падает. При снижении влажности опять повышается. 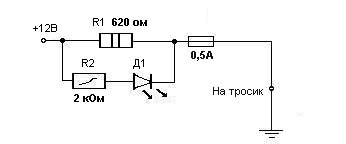
схема на ограничительном резисторе со светодиодом дала хорошие результаты: ржавчина изчезла на сколах краски и теперь там чистый металл за 4 месяца стоянки авто во влажном гараже с подложенными листами железа под машиной (жертвенный металл). Чем больше железа и сырости в гараже тем процесс более ускоряется.
Отсутствие ржавчины в скрытых полостях уменьшает накопление влаги и увеличивает скорость высыхания конденсата под действием КЗ.
Каждый день утром, заглядывая в багажник обнаруживал капли влаги под поликом закрывающим отверстия скрытых полостей , сейчас влаги нет!!!
Я не претендую на сказачное востановление металла, просто хотелось бы оставить сварщика для более нужных работ (хотя бы на несколько лет).
Катодная защита от коррозии ни в коей мере не исключает другие методы борьбы с этим злом! Наоборот, только весь комплекс мероприятий позволит уберечь кузов от ржавчины. Так что за кузовом надо следить, своевременно подкрашивать сколы, установить подкрылки, проводить обработку (хороша смесь на основе пушечного сала) и иногда мыть.
P.S. Вот так выглядит бывшая ржавчина (см.стрелку):

А так устройство реализовано в авто (использована заглушка кнопки):

|


